多靶点描绘复杂的肿瘤微环境对于全面评估患者的预后和接受免疫抑制剂治疗的疗效,挖掘肿瘤微环境与肿瘤发生发展、复发、转移和耐药机制的关系和临床分子机理提供了全新的思路,依托下一代病理技术(NGP),即多重荧光免疫组化技术平台,阔然基因推出了肿瘤免疫微环境全景分析解决方案,助力于更精确的肿瘤免疫和其他药物开发应用。
本期NGP资讯,将为大家分享两篇NGP在肝细胞癌研究中的应用案例。
随着癌症免疫疗法的发展,确定可预测治疗反应的稳健生物标志物至关重要。新型癌症免疫疗法的开发和有效生物标志物的鉴定需要对肿瘤浸润T细胞有深入的了解。
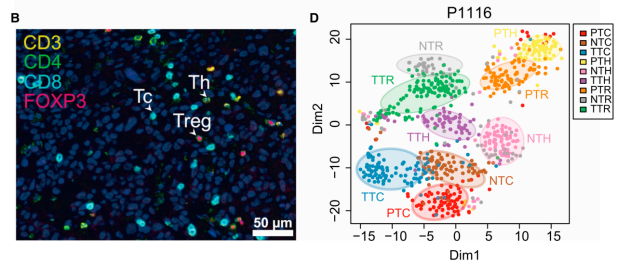
本研究通过六名肝细胞癌(HCC)患者的外周血、肿瘤和邻近正常组织中分离的5063 个单细胞RNA测序和TCR序列分析,根据其分子和功能特性识别出11个T细胞亚群,并描绘其发育轨迹。特定的亚群,如耗竭CD8+ T细胞和调节性T细胞(Tregs),会在HCC中优先富集,通过多重荧光免疫组化(mIHC)进一步证实了HCC中存在CD8+FOXP3+调节性T细胞,表明HCC微环境促进了浸润CD8+ T细胞向耗竭状态的转变。此外,我们鉴定了每个亚群的特征基因。其中编码layilin的LAYN与肿瘤浸润耗尽的CD8+ T细胞有关,导致HCC患者的不良预后。
总之,这份转录组数据揭示了HCC浸润T细胞的详细特征,为了解HCC浸润T细胞等免疫景观提供了宝贵的见解。
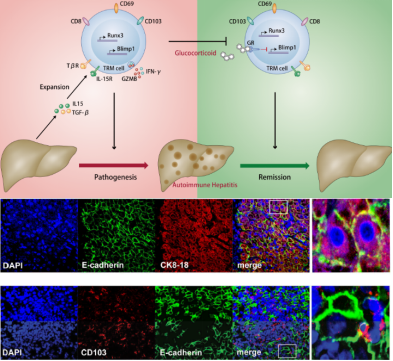
自身免疫性肝炎 (AIH) 患者的肝脏中存在多种炎症反应,但对潜在致病亚群的鉴定仍缺乏有效的生物标志物。
研究者通过对比慢性乙型肝炎、非酒精性脂肪性肝病和健康人的组织,发现AIH患者肝内CD69+ CD103+ CD8+ TRM 细胞显著增加,且与疾病严重程度呈正相关。AIH患者肝内IL-15和TGF-β表达水平显著升高,且肝细胞广泛表达CD103配体- E-钙黏蛋白(E-cadherin),这些因素可能有助于CD8+ TRM细胞的分化和驻留。经过免疫治疗后,AIH患者肝内CD8+ TRM细胞数量显著下降。糖皮质激素可以通过直接下调CD8+ TRM细胞Blimp1的表达,从而抑制CD8+ TRM细胞的体外扩增。
该研究证实了CD69+ CD103+ CD8+ TRM 细胞在AIH发病机制中的重要作用,并可能是疾病持续进展和停药后容易复发的重要预测标志物,为探索新型免疫治疗靶点打下理论基础。
目前,阔然基因已经布局了整套多重荧光免疫组化技术(mIHC)平台,包括Kreep染色试剂盒、KR-HT5高通量荧光病理切片扫描系统和KRIAS医学病理影像分析软件,并开发了6款检测产品。
三大技术突破

依托多重荧光免疫组化技术平台,阔然基因推出了肿瘤免疫微环境全景分析解决方案,全景剖析肿瘤免疫微环境中的杀伤性T细胞、耗竭性T细胞、巨噬细胞、B细胞、三级淋巴结构和免疫检查点受体的浸润情况,全面评估患者的预后和接受免疫抑制剂治疗的疗效,挖掘肿瘤免疫微环境与肿瘤发生发展、复发、转移和耐药机制的关系和临床分子机理。
文献汇编:
[1] Cell. 2017 Jun 15;169(7):1342-1356.e16.[2] Hepatology. 2021;74(2):847-863

